全面認識水系非金屬載流子電池
時間:2020-10-19 09:37來源:微算云平臺 作者:四毛&八毛
點擊:
次
成果簡介
載流子,即溶液中的陰、陽離子,是電池的基本組成部分,決定電池的電化學原理及性能。非金屬載流子是水系電池中替代金屬離子的一種選擇,具有快速動力學、長循環壽命和低制造成本等優勢。非金屬帶電離子不僅可以通過形成共價-離子鍵而嵌入電極中,而且還可以作為可逆的氧化還原中心進行電荷轉移,其性能優于金屬帶電離子。
鑒于此,來自香港城市大學的支春義教授、俄勒岡州立大學的紀秀磊教授等人綜述了非金屬陽、陰離子在水系電池中的物理化學性質、電荷存儲機制及與電極的相互作用,并由此建立了基于非金屬陽、陰離子為基礎的水系電池裝置,對電池的成本、容量、工作電位、倍率性能和循環穩定性進行分析。最后,作者重點介紹了基于非金屬載流子的水系電池的設計策略以及未來應用。相關工作以《Non-metallic charge carriers for aqueous batteries》為題在《Nature Reviews Materials》上發表綜述。
圖文導讀
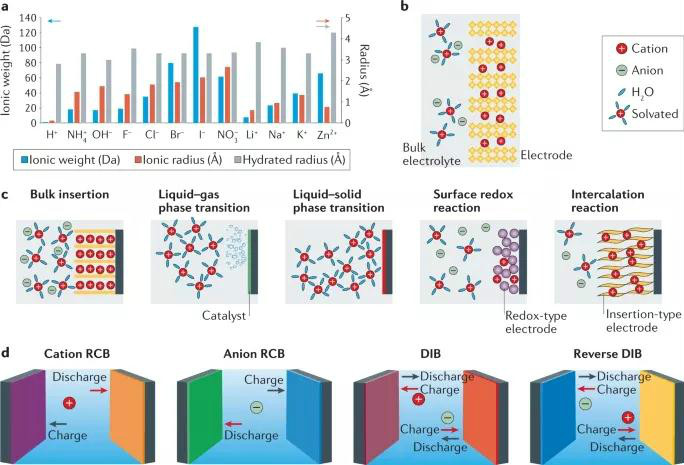
圖1 非金屬載流子在水系電池中的物理化學性質、電荷存儲機制
圖1a所示,在非金屬離子中,H+的離子質量最低,半徑最小,與較大的金屬離子如陽離子Li+、Na+、K+、Zn2+相比,H+的能量密度更高,動力學更快。此外,陰離子型非金屬載流子通常比陽離子型非金屬載流子具有更高的摩爾質量和離子半徑,這導致了不同的電池的原理、性能差異。圖1b所示,非金屬離子在溶劑化和去溶劑下與電極材料相互作用,在非質子溶劑中,溶劑種類和非金屬離子的溶劑化作用對電化學性能有很大影響。
電荷存儲機制可分為離子插層的搖椅反應機制、固-液-氣相中非金屬離子的氧化還原、氧化還原贗電容與插層贗電容(如圖1c所示)。各電池反應具有不同的反應動力學:擴散限制反應具有電池型行為,而非擴散限制反應具有贗電容型行為。電池的種類可以通過分析電解質中非金屬載流子的運動方向來確定:①以陽離子為穿梭離子的搖椅電池;②以陰離子為穿梭離子的搖椅電池;③雙離子電池,其中陽離子移動到陽極,陰離子移動到陰極;④反向雙離子電池,使陽離子移動到陰極,陰離子移動到陽極。
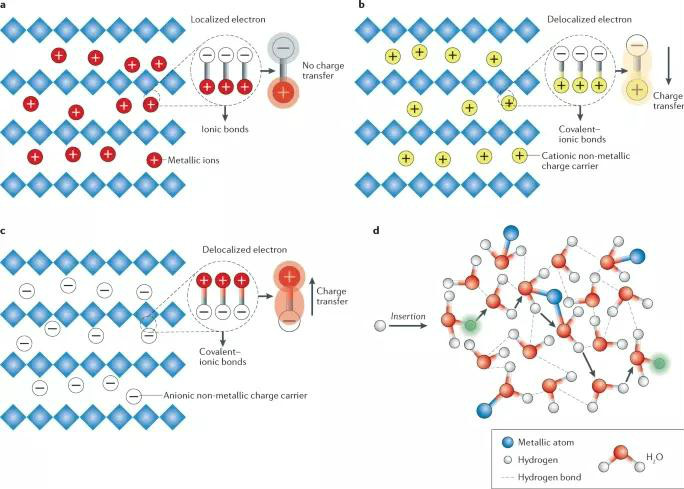
圖2 非金屬離子與電極的相互作用
Li+離子是電池系統中最常用的金屬載流子,其研究主要集中在充放電過程中電極材料的結構演變。Li+離子通過插入電極材料中的相鄰層間或其他未占據的四面體或八面體位置,與結構中其他離子形成離子鍵。例如,在過渡金屬氧化物中,Li+插入后與O原子形成Li-O-M鍵,其中M為過渡金屬離子,如圖2a所示。而在以陽離子為穿梭離子的搖椅電池中,非金屬離子可以與電極中的帶負電荷的原子相互作用,形成雜化共價-離子鍵,如圖2b所示。與純離子鍵不同,共價-離子鍵可通過將電子從主電極框架轉移到插入的非金屬離子上,使電子離域化,非金屬離子可作為一個額外的氧化還原中心。
非金屬陰離子也能在主電極上形成雜化共價-離子鍵,由電極中帶正電荷的金屬原子與之發生相互作用,如圖2c所示。而H+離子的插入行為比較特殊,如圖2d所示,H+的插入是通過連續的打破/形成與晶格水分子間的氫鍵,即H+首先通過與O原子形成氫鍵被吸收到晶格水中,而后所形成的氫鍵轉化為H-O共價鍵,即原始的H2O中O-H鍵被打斷,從而再次形成氫鍵,即H2O•••H+。
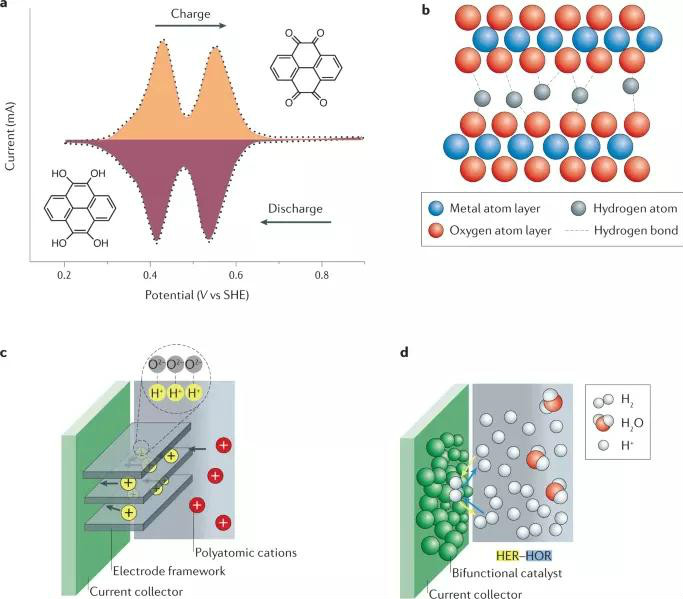
圖3 非金屬陽離子與電極的相互作用
以多原子陽離子NH4+作為電荷載體為例,與酸性電解質相比,含NH4+的電解質表現出弱酸性和較小的腐蝕性,不會導致電極材料的溶解,比含有H+的電解質有著更高的HER過電位。然而,由于NH4+離子的半徑比H+離子大,在嵌入/脫出過程中,電極材料需要更多的空間容納NH4+離子,這會導致電極結構發生極大的變化。如圖3c所示,當發生NH4+離子插入時,根據供體-受體原則,有機物或金屬氧化物中O原子可以作為NH4+離子的結合位點。這種離子插入行為與H+的插入行為一致(圖3a、b)。此外,值得關注的是,在NH4+離子與電極材料間可通過氫鍵進行電荷轉移,從而可以實現高于金屬離子的儲能容量。
此外,非金屬離子也可以通過轉換成中性態來充當氧化還原中心,如利用競爭性反應HER/HOR作為出發點,如圖3d所示,從而突破傳統插入型電極材料的容量限制。
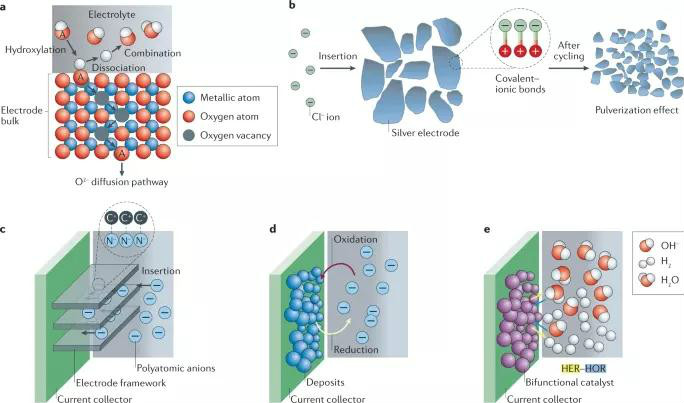
圖4 非金屬陰離子與電極的相互作用
非金屬陰離子電池作為一種新型的電化學儲能器件而越來越受到關注。以可充電堿性電池為例,通常由Zn或Fe金屬作為陽極,Ni基材料作為陰極組成,溶液中的OH-不僅充當金屬絡合劑,還參與電極反應。
堿性電池因陰極的不可逆相變而易發生容量衰減。以鈣鈦礦氧化物的原子模型進行探討,如圖4a所示,在充電過程中,OH-離子首先被吸收,然后通過羥基化過程充滿表面。隨后,OH-離子解離H+離子(H+離子與電解質中的OH-反應),所形成的O2-離子插入電極中,填充內部的Ov,而在放電過程中O2-離子從電極中脫出。因此,在電極中引入Ov為提高電極容量和動力學,從而提高輸出性能提供了一種策略。
此外,Cl-離子也在非水體系中被用作反應載體(在水系環境下,氯化反應導致形成氯鹽,而氯鹽傾向于溶解在電解質水溶液中)。根據Ag電極可被氧化成AgCl,然后在脫氯過程中還原成銀,完成插入-轉換過程。這種可逆的氧化還原過程不會引起溶解等問題,然而,長時間的循環會導致Cl電極的形態和形狀發生變化,如圖4b的電極粉化示意圖。
在水系電池中使用多原子陰離子作為反應載體是具有挑戰性的,多數多原子陰離子的氧化電位高于氧析出反應(OER)電位。“鹽包水”電解質(WiSE)可有效擴大水電解質的電化學穩定窗口,以允許多原子陰離子發生氧化還原。多原子陰離子的脫嵌行為與陽離子類似(圖4c),遵循供體-受體原則。類似地,陰離子也可充當氧化還原中心,如Br-/Br3-、I-/I3-電對(圖4d)。然而,由于氧化產物的溶解,這樣的電池在不使用隔膜的情況下易發生自放電行為。
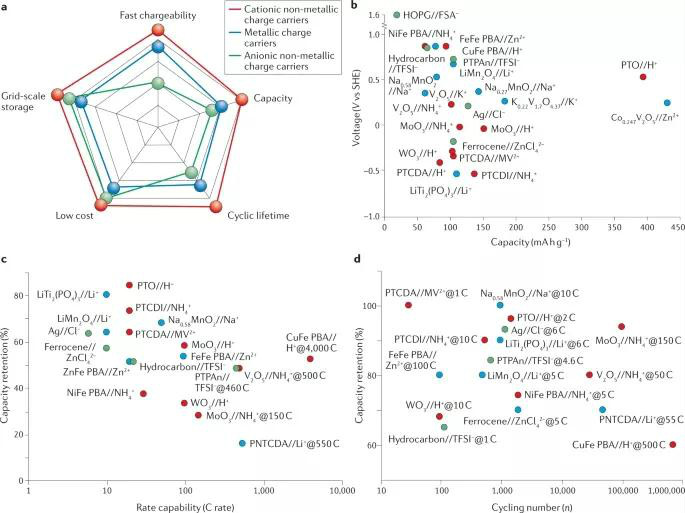
圖5 非金屬離子電池的性能
不管設計哪一類電池,均要以電池的輸出性能為導向。傳統地,金屬離子一直被認為是默認的反應載荷,而電極材料和電解質是決定電池性能的關鍵因素。然而,離子種類也將極大影響電池性能、比容量和能量密度。與金屬離子載荷相比,非金屬離子載荷具有成本低、可大規模儲存、充電速度快、容量大、循環壽命長等特點。由于不同的電極材料會導致不同的性能,在這里作者在同一電極上對帶正電荷的非金屬離子載荷和金屬離子載荷的性能進行了評估:
• 成本。成本是通過輸送一個存儲設施每千瓦電的平均能源成本來評估的。對于水電池系統,除了電池制造成本、維護成本、環境影響和運行成本外,還主要取決于電極材料和電解質成分。因此,可以使用地球豐富的元素和廉價的化學品來降低電解質的成本。如H+、NH4+、I-比金屬離子Li+、Zn2+更加廉價。
• 容量。理論容量大的電極材料可以有效提高輸出容量(圖5b)。在使用相同的電極下,與金屬離子相比,非金屬陽離子儲能具有相當甚至更高的容量,這一方面與他們自身可作為氧化還原中心有關,可通過共價-離子鍵接受額外的電子,還跟其較小的離子半徑有關,可充分利用電極材料的位點。
• 工作電壓。非金屬陽離子有特定的工作電位區間。通過在同一電解液中選擇兩個電勢相差很大的反應,可以獲得較高的輸出電壓。然而,水電解質的電化學穩定窗口(1.23V)較小,限制了電極材料與反應的選擇。使用“鹽包水”電解質可有效擴大水電解質的電化學穩定窗口。
• 倍率性能。在電極中擴散能壘較小的非金屬離子可有效提高電池的倍率性能。此外,離子半徑較小的H+具有超高的倍率性能(4000 C)。NH4+儲能也具有較高的倍率性能(150-500 C),如圖5c所示,而大部分的金屬離子儲能的倍率性能較差(低于100 C),不太適合快速充電。
• 循環性能。非金屬陽離子電池通常比非金屬陰離子電池具有更高的循環壽命。非金屬陽離子由于體積較小,在充放電過程中電極結構變化較小。相比之下,非金屬陰離子電池會出現循環不可逆轉性和溶解問題,導致循環性能較低。另一方面,非金屬離子和金屬離子在使用同一電極材料時循環穩定性的差異,可以歸因于金屬離子的高電荷密度,如Li+與電極產生強烈的靜電相互作用,導致電極的不可逆結構變化和溶解。
文獻信息:
Non-metallic charge carriers for aqueous batteries,Nature Reviews Materials,2020.
Non-metallic charge carriers for aqueous batteries,Nature Reviews Materials,2020.
https://www.nature.com/articles/s41578-020-00241-4
文章標簽:
電池
水系非金屬載流子電池
免責聲明:本文僅代表作者個人觀點,與中國電池聯盟無關。其原創性以及文中陳述文字和內容未經本網證實,對本文以及其中全部或者部分內容、文字的真實性、完整性、及時性本站不作任何保證或承諾,請讀者僅作參考,并請自行核實相關內容。
凡本網注明 “來源:XXX(非中國電池聯盟)”的作品,均轉載自其它媒體,轉載目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責。
如因作品內容、版權和其它問題需要同本網聯系的,請在一周內進行,以便我們及時處理。
QQ:503204601
郵箱:cbcu@www.astra-soft.com
凡本網注明 “來源:XXX(非中國電池聯盟)”的作品,均轉載自其它媒體,轉載目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責。
如因作品內容、版權和其它問題需要同本網聯系的,請在一周內進行,以便我們及時處理。
QQ:503204601
郵箱:cbcu@www.astra-soft.com
猜你喜歡
-
崔屹&H.N. Alshareef:無負極水系鋅-二氧化錳電池
2021-01-22 11:37 -
大連化物所研發出耐低溫水系鋅基電池用電解質溶液
2020-08-31 11:52 -
廣東工業大學《JACS》:一種全新的高性能水系可充電鋁離子電池!
2020-08-31 09:54 -
-78℃超低溫水系電池!
2020-06-16 10:27 -
香港利用護膚霜成分制電解質 制成不易燃且安全的水系鋰離子電池
2020-06-11 08:43 -
最新研發綠色水系電池進入國家電網光儲能系統
2020-06-09 11:09 -
中南大學唐有根-王海燕團隊在水系鋅離子電池研究方面推出新成果
2020-05-13 10:24 -
新型水系鋰離子電池更安全、性價比更高
2020-01-13 10:36 -
水系鋰電池獲關鍵突破,能量密度超 300Wh/kg,或成電池發展未來
2019-06-10 22:09 -
科學家利用新型鹵素轉換插層化學 打造高能鋰離子水系電池
2019-05-24 09:33
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
專題
相關新聞
-
崔屹&H.N. Alshareef:無負極水系鋅-二氧化錳電池
2021-01-22 11:37 -
大連化物所研發出耐低溫水系鋅基電池用電解質溶液
2020-08-31 11:52 -
廣東工業大學《JACS》:一種全新的高性能水系可充電鋁離子電池!
2020-08-31 09:54 -
-78℃超低溫水系電池!
2020-06-16 10:27 -
香港利用護膚霜成分制電解質 制成不易燃且安全的水系鋰離子電池
2020-06-11 08:43 -
最新研發綠色水系電池進入國家電網光儲能系統
2020-06-09 11:09 -
中南大學唐有根-王海燕團隊在水系鋅離子電池研究方面推出新成果
2020-05-13 10:24 -
新型水系鋰離子電池更安全、性價比更高
2020-01-13 10:36
本月熱點
-
2020年鋰電池行業研究報告
2021-05-11 11:24 -
突發|深圳一鋰電企業停止經營、解散員工!
2021-05-11 10:02 -
4月我國動力電池裝車量同比上升134.0%
2021-05-13 08:26 -
如何看待Pack內鐵鋰和三元混用
2021-06-01 09:25 -
可充電中性鋅空氣電池:進展,挑戰和未來
2021-05-19 10:59 -
揭開贛鋒鋰業的家底
2021-06-03 09:46 -
“電池荒”來襲,生產純電動汽車的車企要被卡脖子了?
2021-06-01 21:22 -
關于征集《鋰離子電池用連續式真空干燥系統技術規范》等兩項行業標準的函)征求意見程序
2021-05-31 22:53
 企業微信號
企業微信號 微信公眾號
微信公眾號









